بیشتر واکنش های شیمیایی در صنایع، آزمایشگاه ها و نیز در بدن موجودات زنده در محلول انجام می شوند و تا زمانی که غذا به صورت محلول در نیاید، قابل جذب در بدن نخواهد بود. گیاهان غذای مورد نیاز خود را بصورت محلول جذب می کنند. آب دریاها، دریاچهها، رودخانهها، چاهها و چشمهها و نیز هوایی را که تنفس میکنیم، همه بصورت محلول هستند، بنابراین ما در جهانی از محلولها زندگی میکنیم که در آن، آب مهمترین حلال است.
محلول نوع خاصی از مخلوط دو یا چند ماده است که یک مخلوط یکنواخت را تشکیل میدهد. غلظت یک محلول مقدار ماده حل شده در مقدار معینی حلال یا مقدار ماده حل شده موجود در مقدار معینی از محلول است. غلظت یک ماده حل شده در یک محلول را به روش های گوناگون میتوان بیان کرد که در زیر به آنها اشاره میشود.
تعدادی از واحدهای غلظتی
_ غلظت درصدی
شیمیدانها بیشتر غلظتها را برحسب درصد بیان میکنند. متاسفانه این روش به واسطه راههای متعددی که درصد اجزاء سازنده یک محلول را بیان میکند، میتواند منشاء ابهام باشد. برای رفع ابهام لازم است، که نوع درصد به روشنی مشخص شود. اگر نقصی در این اطلاعات باشد، استفاده کننده ناچار خواهد بود که مطابق برداشت خود تصمیم بگیرد که کدام یک از انواع درصد می تواند صحیح باشد، که در این صورت خطای بالقوه زیادی در رابطه با انتخاب غلط وجود دارد.
_ قسمت در میلیون و واحدهای وابسته
برای محلولهای بسیار رقیق، بهتر است که غلظت را بر حسب قسمت در میلیون بیان کنیم قسمت در میلیون بیانگر حضور یک گرم از جسم مورد نظر در یک میلیون گرم از محلول یا مخلوط است.
_ غلظت معمولی
غلظت معمولی که ارزش عملی کمتری دارد، عبارتست از وزن ماده با واحد گرم که در یک لیتر محلول وجود دارد و آن را با علامت (C) نشان می دهند.
_ مولاریته یا غلظت مولار
مولاریته یا غلظت مولار یک گونه شیمیایی X که با (CX) نشان داده میشود، عبارت است از تعداد وزن مولکول گرم یا تعداد مول های یک جسم حل شده در یک لیتر محلول
_ مولالیته یا غلظت مولال
مولالیته یا غلظت مولال عبارت است از تعداد مولهای حل شده در یک کیلوگرم حلال
ظرفیت موثر در واکنش ها:
حالت اول: واکنش اسید و باز (خنثی شدن)
حالت دوم: واکنش اکسایش – کاهش
حالت سوم: واکنش رسوبی یا تشکیل کمپلکس
چگونه مسئله های شیمی را حل کنیم:
- به آنچه که در مسئله داده شده و آنچه از شما خواسته شده است دقیقا توجه کنید. اگر در مسئله شرایط خاصی وجود دارد به آن توجه کنید. مطمئن شوید که مفهوم همه عبارات و واحدها را میدانید و با همه اصول شیمیایی مربوط به مسئله آشنا هستید. هر مسئله برای نشان دادن یک اصل، رابطه، قانون، تعریف یا واقعیتی طرح شده است.
- مشخص کنید چگونه می توان مسله را حل کرد پیش از حل مسئله به جزئیات راه حل بیندیشید.
- نتایج را بررسی کنید، پس از حل مسئله بررسی کنید که آیا پاسخ شما منطقی و قابل قبول است یا خیر. این قسمت را در دو مرحله انجام دهید.
روش ضربدری در حل مسائل محلول سازی
همیشه در خط اول تعریف واحد را مینویسیم و در خط دوم، اطلاعات مربوط به محلول مورد نظر را مینویسیم.
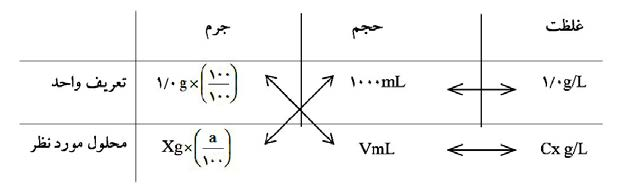
شکل (1) : روش ضربدری برای حل سوال غلظت معمولی
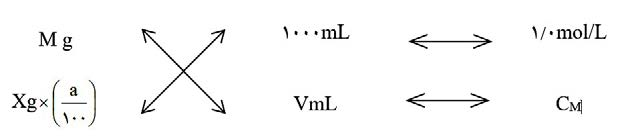
شکل (2): روش ضربدری برای حل سوال مولاریته
برای حل مسائل محلولسازی میتوان از روشهای مختلفی استفاده کرد. از جمله این روشها میتوان به روشهای نسبتها، روش ضریب تبدیل، روش فرمولی و روش ضربدری اشاره کرد. برای توضیحات بیشتر و دقیقتر، این مقاله در شماره 37 فصلنامه دانش آزمایشگاهی ایران (بهار 1401) منتشر شده است.
منبع: http://ijlk.ir

